Μαιευτική Γυναικολογική Μέριμνα
Κυτταρομεγαλοϊός (CMV) Στην Εγκυμοσύνη
Ο κυτταρομεγαλοϊός είναι η πιο κοινή αιτία ενδομήτριας λοίμωξης , και είναι μια κοινή αιτία της νευροαισθητήριας απώλειας ακοής και νοητικής υστέρησης . Η Πρωτοπαθής λοίμωξη ορίζεται ως CMV μόλυνση σε μια προηγουμένως οροαρνητική γυναίκα . Η δευτερεύουσα μόλυνση ορίζεται ως διαλείπουσα απέκκριση του ιού υπό την παρουσία ανοσίας του ξενιστή (της εγκύου) και μπορεί να οφείλεται είτε σε επανενεργοποίηση ενός ενδογενούς ιού ( 1 ), ή έκθεση σε ένα νέο στέλεχος του ιού από μία εξωγενή πηγή . Πρωτοπαθής λοίμωξη ονομάζεται η λοίμωξη την πρώτη φορά . Είναι σημαντικό να το γνωρίζουμε . Η λοίμωξη την δεύτερη φορά είναι πιό ήπια , λόγω προϋπάρχοντων αντισωμάτων , λόγω δηλαδή σχετικής ή και απόλυτης ανοσίας . Συνήθως θα χαρακτηρίζαμε "απόλυτη" την ανοσία όταν το άτομο δεν νοσεί (δεν εμφανίζει συμπτώματα) Στην εγκυμοσύνη όμως μας ενδιαφέρει και το παιδί , και συνεπώς χαρακτηρίζουμε την ανοσία απόλυτη όταν η λοίμωξη δεν μεταφέρεται στο παιδί . Στην δευτεροπαθή λοίμωξη , την λοίμωξη δηλαδή που συμβαίνει δεύτερη φορά στη ζωή της εγκύου , δεν υπάρχουν συμπτώματα της νόσου , αλλά δεν συμβαίνει (στην πλειονότητα των περιπτώσεων) και διαπλακουντιακή μετάδοση . Αυτές οι βασικές αρχές ισχύουν σε όλες τις λοιμώξεις . Η όλη συζήτηση γίνεται για τις περιπτώσεις που έχουμε υπόνοιες ότι η λοίμωξη της εγκύου είναι πρωτοπαθής ή που η λοίμωξη πιθανόν να οφείλεται σε νέο στέλεχος του ιού , οπότε έχουμε μια ενδιάμεση κατάσταση ανοσίας . Πρόσφατα αξιολογούνται δύο εμβόλια CMV , ενώ περισσότερα είναι γνωστά για το μηχανισμό της διαπλακουντιακής εξάπλωσης του ιού και της φυσικής ιστορίας της συγγενούς λοίμωξης .
Αν και η διάγνωση της συγγενούς CMV μόλυνσης εξακολουθεί να είναι πολύπλοκη , σημαντικοί στόχοι έχουν επιτευχθεί κατά τα τελευταία έτη , μεταξύ των οποίων είναι : δοκιμές για τον προσδιορισμό του δείκτη δύναμης σύνδεσης (Avidity) των αντι- CMV IgG , επιτρέποντας έτσι τη διάγνωση μιας πρωτοπαθούς λοίμωξης CMV , και καινοτόμων ορολογικών δοκιμασιών για την ανίχνευση του ιού στο αμνιακό υγρό . Εδώ , θα επανεξετάσω τις πρόσφατες εξελίξεις στην κατανόησή μας για τη διάγνωση , τη θεραπεία και την πρόληψη της συγγενούς λοίμωξης CMV .
Ο CMV είναι ο μεγαλύτερος σε μέγεθος από την οικογένεια των ανθρώπινων ερπητοϊών : Η μετάδοσή του γίνεται με στενή επαφή , με μόλυνση από τα ούρα , το σάλιο , το αίμα , το σπέρμα και τις εκκρισεις του τραχήλου ( 15 ) . Κάθετη μόλυνση (προγεννητικώς διαμέσου του πλακούντα) μπορεί να συμβεί , όπως επίσης κατά τη διάρκεια του τοκετού (τραχηλικές βλέννες) και του θηλασμού .
Οι περισσότερες λοιμώξεις από CMV που συναντώνται σε έγκυες γυναίκες είναι ασυμπτωματικές , ακόμη και κατά τη διάρκεια της οξείας φάσης . Λιγότερο από το 5 % των εγκύων γυναικών με πρωτογενή μόλυνση έχουν αναφερθεί να είναι συμπτωματικές , και ένα ακόμα μικρότερο ποσοστό πάσχουν από σύνδρομο που μοιάζει με λοιμώδη μονοπυρήνωση ( 16 ) . Τα πιο συχνά συμπτώματα περιλαμβάνουν αίσθημα κακουχίας , επίμονο πυρετό , μυαλγία , τραχήλική λεμφαδενοπάθεια (λεμφαδένες στο λαιμό όχι στον τράχηλο της μήτρας) , και , λιγότερο συχνά , πνευμονία και ηπατίτιδα ( 17 ) .
Οι Εργαστηριακές εξετάσεις μπορούν μερικές φορές να αποκαλύψουν άτυπα λεμφοκύτταρα και ελαφρώς αυξημένα επίπεδα τρανσαμινασών . Οι Εργαστηριακές δοκιμές ( ιολογίας και ορολογικές εξετάσεις) είναι το καλύτερο μέσο για τη διάγνωσης . Η διάγνωση της πρωτοπαθούς λοίμωξης CMV είναι απλή, αν ανιχνευτεί ορομετατροπή σε CMV . Ωστόσο , δεδομένου ότι η τεκμηρίωση ορομετατροπής σε CMV είναι σπάνια, καθώς οι γυναίκες δεν ελέγχονται συνήθως σε διαλογή για αντισώματα CMV πριν την κύηση, η ανίχνευση του CMV IgM έχει χρησιμοποιηθεί ως ένας δείκτης της πρόσφατης λοίμωξης CMV. Διαφορετικά κιτ μπορούν να χρησιμοποιηθούν και η συμφωνία μεταξύ τους ποικίλλει από 56 % έως 75% με ευαισθησία μεταξύ 30 % και 88 % ( 18 ) . Ο αναγνώστης πρέπει να καταλάβει ότι ακόμα και οι εργαστηριακές εξετάσεις δεν είναι πανάκεια , κάνουν και αυτές λάθος , χάνουν περιστατικά , «μπερδεύονται» κλπ . Η Ιατρική , είναι πολύπλευρη επιστήμη και βασίζεται σε πολλαπλά στοιχεία με κυριότερο όλων την κλινική εξέταση .
Όταν τα αντισώματα αντι- CMV IgM ανιχνεύονται σε μια έγκυο γυναίκα , η
διάγνωση παραμένει ανοικτή , επειδή δεν μπορούν να συσχετίζεται μόνο και
πάντα με πρωτογενή μόλυνση . Στην πραγματικότητα , οι έγκυες γυναίκες
μπορούν να παράγουν IgM κατά επανενεργοποιήσεων ή επαναλοιμώξεων ( 18 )
. Επιπλέον , τα αντισώματα αντι - CMV IgM ανιχνεύθηκαν σε κάποιες έγκυες
γυναίκες από έξι έως εννέα μήνες μετά το τέλος της οξείας φάσης της
πρωτογενούς λοίμωξης ( 19 ) , και ψευδώς θετικά αποτελέσματα είναι κοινά
( 18,20 ) και μπορεί να προκύψουν και με άλλες ιογενείς λοιμώξεις (
B19Virus , ιός Epstein Barr , κλπ). Η δοκιμασία δύναμης σύνδεσης IgG
αντι - CMV (avidity) είναι σήμερα η πιο αξιόπιστη διαδικασία για τον
εντοπισμό πρωτογενούς λοίμωξης σε έγκυες γυναίκες ( 18,21-23 ) . Η
δοκιμή δύναμης σύνδεσης IgG είναι εξαιρετικά ειδική ( 100 %) και
ευαίσθητη ( 94,3 %).
Ο βαθμός της δύναμης σύνδεσης αντισώματος (avidity) αυξάνει σταδιακά και
αργά αντανακλώντας την ωρίμανση της ανοσοαπόκρισης .
Χαμηλος δείκτης δύναμης σύνδεσης υποδεικνύει χαμηλής συγγένειας IgG
αντισώματα στον ορό που προκαλείται από οξεία ή πρόσφατη πρωτογενή
λοίμωξη CMV ( 18 ) . Οι χαμηλοί δείκτες δύναμης σύνδεσης που συναντώνται
18-20 εβδομάδες μετά την έναρξη των συμπτωμάτων σε ανοσοκατεσταλμένους
ασθενείς .
Ο προσδιορισμός της αντι - CMV IgG avidity , πραγματοποιείται πριν από την 16η-18η εβδομάδα της εγκυμοσύνης , και προσδιορίζει όλες τις γυναίκες που θα έχουν ένα μολυσμένο έμβρυο / νεογνό ( ευαισθησία 100 % ) . Μετά από την 20η εβδομάδα κύησης, η ευαισθησία μειώνεται δραστικά ( 62,5 %) ( 24 ) . Ένας δείκτης υψηλής συνάφειας κατά τις πρώτες 12-16 εβδομάδες της κύησης θα μπορούσε να θεωρηθεί ως μια καλή ένδειξη της παρελθούσας λοίμωξης . Η παρουσία του αληθινού IgM σε συνδυασμό με χαμηλό / μέτριο δείκτη avidity έχει την ίδια διαγνωστική αξία ως ορομετατροπή ( 20,23,25 ) . Οι ιολογικές δοκιμές παίζουν δευτερεύοντα ρόλο στη διάγνωση της πρωτοπαθούς λοίμωξης CMV σε έγκυες γυναίκες . Απομόνωση του ιού στα ούρα και / ή εκκρίσεις του τραχήλου της μήτρας είναι φτωχός δείκτης του κινδύνου της ενδομήτριας μετάδοσης και της σοβαρότητας της εμβρυϊκής / νεογνικής λοιμώξεως. Ο CMV μπορεί να ανιχνευθεί στο αίμα με απομόνωση του ιού ή / και την αναζήτηση ιικών συστατικών από τις δοκιμές αντιγοναναιμίας και την αντίδραση πολυμεράσης (PCR ) . Παρ όλα αυτά , τα αποτελέσματα αυτών των διαγνωστικών δοκιμών αποτυγχάνουν επίσης να συσχετίζονται είτε με την κλινική πορεία της λοίμωξης και / ή τον κίνδυνο της ενδομήτριας μετάδοσης και της σοβαρότητας της εμβρυϊκής / νεογνική ζημίας ( 20,26 ) . Δύο δοκιμές αντιγοναναιμίας και PCR είχαν μια χαμηλή ευαισθησία ( 14,3 % και 47,6 %, αντίστοιχα ) για την ανίχνευση της κάθετης μετάδοσης CMV σε μια ομάδα εγκύων γυναικών που απέκτησαν πρωτογενή μόλυνση CMV μεταξύ τεσσάρων και 30 - εβδομάδων κύησης . Η ειδικότητα (Specificity) και η θετική προγνωστική αξία ήταν επίσης κακές ( 20 ) .Τα ευρήματα αυτά υποδηλώνουν ότι ο CMV μερικές φορές μπορεί και άλλες φορές δεν μπορεί να ανιχνευθεί στο μητρικό αίμα σε έγκυες γυναίκες που υποβάλλονται σε πρωτογενή μόλυνση κατά τη στιγμή της διάγνωσης . Απλή Θετική ιική ανίχνευση δεν συσχετίζεται με μεγαλύτερο κίνδυνο λοίμωξης ή / και του εμβρυϊκή / νεογνική ζημία ( 20 ) . Συμπερασματικά , η διάγνωση της πρωτοπαθούς λόιμωξης της μητέρας κατά τη διάρκεια της εγκυμοσύνης θα πρέπει να βασίζεται σε de - novo εμφάνιση του ιού - ειδικών IgG στον ορό της εγκύου γυναίκας που ήταν προηγουμένως οροαρνητική , ή στην ανίχνευση των ειδικών αντισωμάτων IgM που συνδέονται με χαμηλή IgG avidity .
Η διάγνωση της δευτερογενούς μόλυνσης θα πρέπει να βασίζεται σε μια σημαντική αύξηση του τίτλου αντισωμάτων IgG με ή χωρίς την παρουσία των IgM και IgG υψηλής avidity .
Στο πλαίσιο της βιοχημείας, η avidity αναφέρεται στην συσσωρευμένη δύναμη των πολλαπλών χημικών συγγενειών των μεμονωμένων μη-ομοιοπολικών αλληλεπιδράσεων δέσμευσης, όπως ανάμεσα σε ένα αντίσωμα και ένα αντιγόνο , και που συνήθως αναφέρονται ως λειτουργική συνάφεια . Πρακτικά , ένα αντίσωμα με υψηλή avidity είναι περισσότερο εξειδικευμένο και περισσότερο αποτελεσματικό . Στην αρχή της λοίμωξης βγαίνουν αντισώματα χαμηλής avidity και στην πορεία , τα αντισώματα εξειδικεύονται και η avidity αυξάνεται . Γι’αυτό το λόγο και στο κείμενό μου χρησιμοποίησα την έκφραση «βαθμός της δύναμης σύνδεσης αντισώματος» , ο οποίος περιγράφει επαρκώς το νοήμα .
Υπερηχογραφία
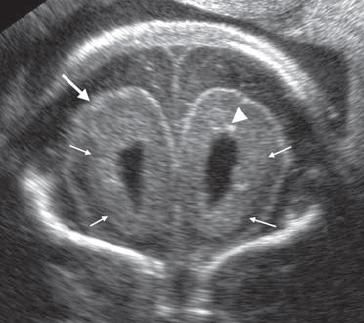
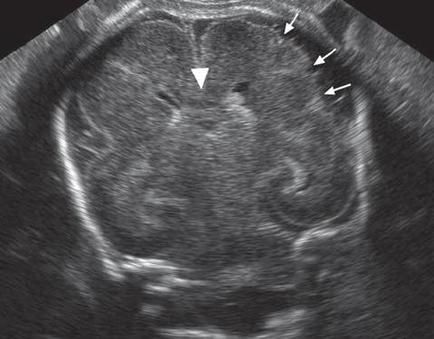
Εξέταση στην 22η εβδομάδα . Ελαφριά αύξηση μεγέθους των κοιλίων του εγκεφάλου .Αυξημένες διαστάσεις του υπαραχνοειδούς χώρου . Περικοιλιακή υπερηχογένεια (μικρά βέλη) . Διάταση των πλαγίων κοιλίων του εγκεφάλου στις 22 εβδομάδες
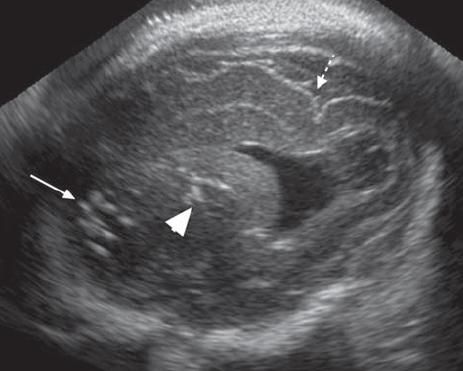
Ασβεστώσεις στις 30 Εβδομάδες Κύησης
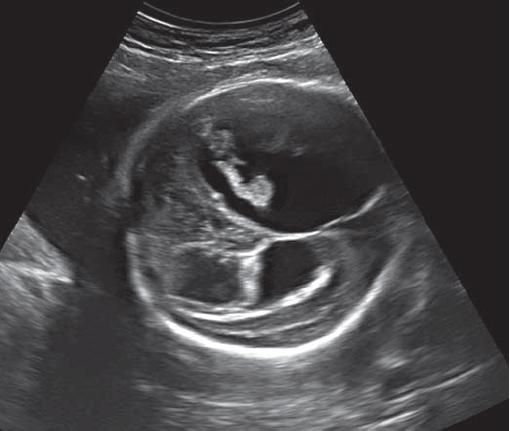
Σοβαρότατος ασύμμετρος υδροκέφαλος στις 30 εβδομάδες
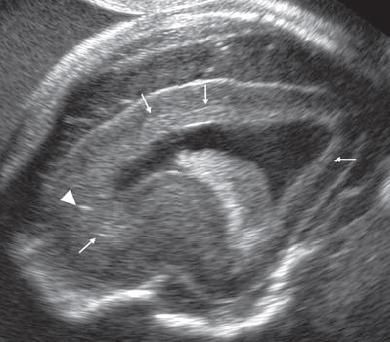
Εξέταση στην 23η εβδομάδα κύησης
Παθολογική ανάπτυξη εγκεφάλου , τα μικρά βέλη εντοπίζουν μια περιοχή
στην οποία οι έλικες του εγκεφάλου δεν αναπτύσσονται σωστά , μια
κατάσταση που ονομάζεται πολυμικρογυρία .
Το παχύ βέλος δείχνει την δυσγενεσία του μεσολοβίου , που συχνά
συνυπάρχει .
Προσέξτε την φυσιολογική δομή στην απέναντι πλευρά
Η αύλακα στην απέναντι πλευρά είναι η αύλακα του Sylvius .
Δείτε Επίσης
Θρομβοφιλία (κληρονομική ή και επίκτητη)
[ Επικοινωνία ] [ Αρχή Σελίδας ] [ Sitemap ]
Τεκμηρίωση - Βιβλιογραφία (πολλά από τα άρθρα μπορείτε να τα βρείτε στο Medline σε free full text . Ολα μπορείτε να τα βρείτε ώς abstracts) .
1. Alford CA, Stagno S, Pass RF, Britt WJ. Congenital and perinatal
cytomegalovirus infections. Rev Infect Dis 1990;12:S745-53.
2. Peckham CS. Cytomegalovirus infection: congenital and neonatal
disease. Scand J Infect Suppl 1991;78:82-7.
3. Fowler KB, Stagno S, Pass RF, Britt WJ, Boll TJ, Al- ford CA. The
outcome of congenital cytomegalovirus in relation to maternal antibody
status. N Engl J Med 1992;326:663-7.
4. Kenneson A, Cannon MJ. Review and meta-analy- sis of the epidemiology
of congenital cytome- galovirus (CMV) infection. Rev Med Virol
2007;17:253-76.
5. Boppana SB, Fowler KB, Britt WJ, Stagno S, Pass RF. Symptomatic
congenital cytomegalovirus infection infants born to mothers with
preexisting immunity to cytomegalovirus. Pediatrics 1999;104:55- 60.
6. Gaytant MA, Rours GI, Steegers EA, Galama JM, Semmekrot BA.
Congenital cytomegalovirus infection after recurrent infection: case
reports and review of the literature. Eur J Pediatr 2003;162:248-53.
7. Boppana SB, Rivera LB, Fowler KB, Mach M, Britt WJ. Intrauterine
transmission of cytomegalovirus to infants of women with preconceptional
immunity. N Engl J Med 2001;344:1366-71.
8. Raynor BD. Cytomegalovirus infection in pregnancy. Semin Perinatol
1993;17:394-402.
9. Pass RF, Fowler KB, Boppana SB, Britt WJ, Stag- no S. Congenital
cytomegalovirus infection following first trimester maternal infection:
symptoms at birth and outcome. J Clin Virol 2006;35:216-20.
10. Lazzarotto T, Varani S, Guerra B, Nicolosi A, Lanari M, Landini MP.
Prenatal indicators of congenital cytomegalovirus infection. J Pediatr
2000a;137:90-5.
11. Ville Y. The megalovirus. Ultrasound Obstet Gynecol 1998;12:151-3.
12. Yow MD. Congenital cytomegalovirus disease: a NOW problem J Infect
Dis 1989;159:163-7.
13. Nelson CT, Demmler GJ. Cytomegalovirus infection in the pregnant
mother, fetus, and newborn infant. Clin Perinatol 1997;24:151-60.
14. Naessens A, Casteels A, Decatte L, Foulon W. A serologic strategy
for detecting neonates at risk for congenital cytomegalovirus infection.
J Pediatr 2005.
15. Stagno S, ritt B. Cytomegalovirus. In: Remington JS, Klein JO,
Wilson CB, Baker CJ, editors. Infectious Diseases of the Fetus and
Newborn Infant, 6th edn. Philadelphia, PA: Elsevier Saunders;
2006.p.740e81
16. Pass RF, Boppana S. Cytomegalovirus Viral infection in obstetrics
and gynaecology. New York, NY: Arnold; 1999. p. 35-6.
17. Gaytant MA, Steegers EA, Semmekrot BA, Merkus HM, Galama
JM.Congenital cytomegalovirus infection: review of the epidemiology and
outcome. Obstet Gynecol Surv 2002; 57:245-56.
18. Lazzarotto T, Spezzacatena P, Pradelli P, Abate DA, Varani S,
Landini MP. Avidity of immunoglobulin G directed against human
cytomegalovirus during primary and secondary infections in
immunocompetent and immunocompromised subjects. Clin Diagn Lab Immunol
1997a;4:469-73.
19. Stagno S, Pass RF, Cloud G, Britt WJ, Henderson RE, Walton PD, et
al. Primary cytomegalovirus infection in pregnancy. Incidence,
transmission to fetus, and clinical outcome. JAMA 1986;256:1904-8.
20. Lazzarotto T, Gabrielli L, Lanari M, Guerra B, Bel- lucci T, Sassi
M, et al. Congenital cytomegalovirus infection: recent advances in the
diagnosis of maternal infection. Hum Immunol 2004;65:410-5.
21. Grangeot-Keros L, Mayaux MJ, Lebon P, Freymuth F, Eugene G, Stricker
R, Dussaix E. Value of cytomegalovirus (CMV) IgG avidity index for the
diagnosis of primary infection in pregnant women. J Infect Dis
1997;175:944-6.
22. Eggers M, Bader U, Enders G. Combination of mi- croneutralization
and avidity assays: improved diagnosis of recent primary human
cytomegalovirus infection in single serum sample of second trimester
pregnancy. J Med Virol 2000;60:324-30.
23. Mace M, Sissoeff L, Rudent A, Grangeot-Keros L. A serological
testing algorithm for the diagnosis of primary CMV infection in pregnant
women. Prenat Diagn 2004;24:861-3.
24. Lazzarotto T, Varani S, Spezzacatena P, Gabrielli L, Pradelli P,
Guerra B, et al. Maternal IgG avidity and IgM detected by blot as
diagnostic tools to identify pregnant women at risk of transmitting
cytomegalovirus. Viral Immunol 2000;13:137-41.
25. Munro SC, Hall B, Whybin LR, Leader L, Robertson
P, Maine GT, et al. Diagnosis of and screening for cytomegalovirus
infection in pregnant women. J Clin Microbiol 2005;43:4713-8
26. Revello MG, Zavattoni M, Sarasini A, Percivalle E, Simoncini L,
Gerna G. Human cytomegalovirus in blood of immunocompetent persons
during primary infection: prognostic implications for pregnancy. J
Infect Dis 1998a;177:1170-5.
27. Lipitz S, Achiron R, Zalel Y, Mendelson E, Tepper- berg M, Gamzu
R.Outcome of pregnancies with vertical transmission of primary
cytomegalovirus infection. Obstet Gynecol 2002;100:428-33.
28. Crino JP. Ultrasound and fetal diagnosis of perinatal infection.
Clin Obstet Gynecol 1999; 42:71-80.
29. Malinger G, Lev D, Zahalka N, Ben Aroia Z, Wa- temberg N, Kidron D,
et al. Fetal cytomegalovirus infection of the brain: the spectrum of
sonograph- ic findings. AJNR Am J Neuroradiol 2003;24:28-32.
30. Picone O, Simon I, Benachi A, Brunelle F, Sonigo P. Comparison
between ultrasound and magnetic resonance imaging in assessment of fetal
cytomegalovirus infection. Prenat Diagn 2008;28:753-8.
31. Benoist G, Salomon LJ, Mohlo M, Suarez B, Jacquemard F, Ville Y.
Cytomegalovirus-related fetal brain lesions: comparison between targeted
ultrasound examination and magnetic resonance imaging. Ultrasound Obstet
Gynecol 2008; Epub ahead of print
32. Hohlfeld P, Vial Y, Maillard-Brignon C, Vaudaux B, Fawer CL.
Cytomegalovirus fetal infection: prenatal diagnosis.Obstet Gynecol
1991;78:615-8.
33. Donner C, Liesnard C, Brancart F, Rodesch F. Accuracy of amniotic
fluid testing before 21 weeks gestation in prenatal diagnosis of
congenital cytomegalovirus infection. Prenat Diagn 1994;14:1055-9.
34. Lipitz S, Yagel S, Shalev E, Achiron R, Mashiach S, Schiff E.
Prenatal diagnosis of fetal primary cytomegalovirus infection. Obstet
Gynecol 1997; 89:763-7.
35. Nigro G, Mazzocco M, Anceschi MM, La Torre R, An- tonelli G, Cosmi
EV.Prenatal diagnosis of fetal cytomegalovirus infection after primary
or recurrent maternal infection. Obstet Gynecol 1999;94:909-14
36. Enders G, Bader U, Lindemann L, Schalasta G, Daiminger A. Prenatal
diag- nosis of congenital cytomegalovirus infection in 189 pregnancies
with known outcome. Prenat Diagn 2001;21:362-77.
37. Revello MG, Gerna G. Diagnosis and management of human
cytomegalovirus infection in the mother, fetus, and newborn infant. Clin
Microbiol Rev 2002;15:680-715.
38. Guerra B, Lazzarotto T, Quarta S, Lanari M, Bovi- celli L, Nicolosi
A, et al. Prenatal diagnosis of symptomatic congenital cytomegalovirus
infection. Am J Obstet Gynecol 2000;183:476-82.
39. Ornoy A, Diav-Citrin O. Fetal effects of primary and secondary
cytomegalovirus infection in pregnancy. Reprod Toxicol 2006;21:399-409
40. Bodeus M, Hubinont C, Bernard P, Bouckaert A, Thomas K, Goubau P.
Prenatal diagnosis of human
cytomegalovirus by culture and polymerasec chain reaction: 98
pregnancies leading to congenital infection. Prenat Diagn 1999;19:314-7.
41. Nicolini U, Kustermann A, Tassis B, Fogliani R, Gal- imberti A,
Percivalle E, et al. Prenatal diagnosis of congenital human
cytomegalovirus infection. Prenat Diagn 1994;14:903-6.
42. Revello MG, Gorini G, Gerna G. Clinical evaluation of a
chemiluminescence immunoassay for determination of immunoglobulin G
avidity to human cytomegalovirus. Clin Diagn Lab Immunol 2004; 11:801-5.
43. Gleaves CA, Smith TF, Shuster EA, Pearson GR. Rapid detection of
cytomegalovirus in MRC-5 cells inoculated with urine specimens by using
low-speed centrifugation and monoclonal antibody to an early antigen. J
Clin Microbiol 1984;19:917-9.
44. Lazzarotto T, Varani S, Gabrielli L, Spezzacatena P, Landini MP. New
advances in the diagnosis of congenital cytomegalovirus infection.
Intervirology 1999;42:390-7.
45. Daniel Y, Gull I, Peyser MR, Lessing JB. Congenital cytomegalovirus
infection. Eur J Obstet Gynecol Reprod Biol 1995;63:7-16
46. Ruellan-Eugene G, Barjot P, Campet M, Vabret A, Herlicoviez M,
Muller G, et al. Evaluation of viro- logical procedures to detect fetal
human cytomegalovirus infection: avidity of IgG antibodies, virus
detection in amniotic fluid and maternal serum. J Med Virol
1996;50:9-15.
47. Gouarin S, Gault E, Vabret A, Cointe D, Rozenberg F, Grangeot-Keros
L, et al. Real time PCR quantification of human cytomegalovirus DNA in
amni- otic fluid samples from mothers with primary infection. J Clin
Microbiol 2002;40:1767-72.
48. Guerra B, Simonazzi G, Banfi A, Lazzarotto T, Farina A, Lanari M, et
al., Rizzo N. Impact of diagnostic and confirmatory tests and prena- tal
counseling on the rate of pregnancy termination among women with
positive cytomegalovirus immunoglobulin M antibody titers. AJOG
2007;196:221.e1-6.
49. Revello MG, Zavattoni M, Baldanti F, Sarasini A, Paolucci S, Gerna
G.Diagnostic and prognostic value of human cytomegalovirus load and IgM
antibody in blood of congenitally infected newborns. J Clin
Virol1999;14:57-66.
50. Ross SA, Boppana SB. Congenital cytomegalovirus infection: outcome
and diagnosis. Semin Pediatr Infect Dis 2005;16:44-9.
51. Lanari M, Lazzarotto T, Venturi V, Papa I, Gabriel- li L, Guerra B,
et al.Neonatal cytomegalovirus blood load and risk of sequele in symp-
tomatic and asymptomatic congenitally infected newborns. Pediatric
2006;117:e76-83.
52. Boppana S, Pass RF, Britt WS, Stagno S, Alford CA. Symptomatic
congeni- tal cytomegalovirus infection: neonatal and mortality. Pediatr
Infect Dis1992;11:93-9.
53. Barbi M, Binda S, Caroppo S, Primache V. Neonatal screening for
congen- ital cytomegalovirus infection and hearing loss. J Clin Virol
2006;35:206-9.
54. Nigro G, Alder SP, La TorreR, Best AM, for the Congenital
Cytomegalovirus Collaborating Group. Passive immunization during
pregnancy for congenital cytomegalovirus infection. N Engl J Med 2005;
353:1350-62.
55. Stuart P.Adler, Giovanni Nigro. Findings and conclusion from CMV
hyperimmune globulin treatment trials. Journal of Clinica Virology
46S(2009) S54-S57
56. Duff P. A thoughtful algorithm for the accurate diagnosis of primary
CMVinfection in pregnancy. Am J Obstet Gynecol 2007;196:196-7.
57. Jacquemard F, Yamamoto M, Costa JM, Romand S, Jaqz-Aigrain E, Dejean
A, Daffos F, Ville Y. Maternal administration of valaciclovir in
symptomatic intrauterine cytomegalovirus infection. BJOG. 2007
Sep;114(9):1113-21. Epub 2007 Jul 6.
58. Miller BW, Howard TK, Goss JA, Mostello DJ, Hol- comb WL Jr, Brennan
DC. Renal transplantation one week after conception. Transplantation.
1995 Dec 15;60(11):1353-4.
59. Brandy RC, Schleiss MR, Witte DP, Siddiqi TA, Fame PT. Placental
transfer of ganciclovir in a woman with acquired immunodeficiency
syndrome and cytomegalovirus disease. Pediatr Infect Dis J. 2002
Aug;21(8):796-7.
60. Puliyanda DP, Silverman NS, Leham D, et all: successful use of oral
ganciclovir for the treatment of intrauterine cytomegalovirus infection
in a renal al- lograft recipient. Transpla Infect Dis 7:71-74,2005.
61. Adler SP, Finney JW, Manganello AM, Best AM. Prevention of
child-to-mother transmission of cytome- galovirus by changing behaviors:
a randomized controlled trial. Pediatr Infect Dis J 1996;15: 240-6.
62. Adler SP, Nigro G, Pereira L. Recent advances in the prevention and
treatment of congenital cytomegalovirus infections. Semin Perinatol
2007; 31:10-8.
63. Kimberlin DW, Lin CY, Sanchez PJ, Demmler GJ, Dankner W, Shelton M,
Jacobs RF, Vaudry W, Pass RF, Kiell JM, Soong SJ, Whitley RJ; Effect of
ganci- clovir therapy on hearing in symptomatic congenital
cytomegalovirus disease involving the central nervous system: a
randomized, controlled trial. National Institute of Allergy and
Infectious Diseases Collaborative Antiviral Study Group. J Pediatr.
2003.
64. Michaels MG, Greenberg DP, Sabo DL, Wald ER. Treatment of children
with congenital cytomegalovirus infection with ganciclovir. Pediatr
Infect Dis J. 2003 Jun;22(6):504-9.
65. Nigro G, Scholz H, Bartmann U Ganciclovir therapy for symptomatic
congenital cytomegalovirus infection in infants: a two-regimen
experience. J Pediatr. 1994 Feb;124(2):318-22.
66. Vallejo JG, Englund JA, Garcia-Prats JA, Demmler GJ. Ganciclovir
treatment of steroid-associated cytomegalovirus disease in a
congenitally infected neonate. Pediatr Infect Dis J. 1994 Mar;13(3):239.
67. Whitley RJ, Cloud G, Gruber W, Storch GA, Demm-
ler GJ, Jacobs RF, Dankner W, Spector SA, Starr S, Pass RF, Stagno S,
BrittWJ, Alford C Jr, Soong S, Zhou XJ, Sherrill L, FitzGerald JM,
Sommadossi JP. Ganciclovir treatment of symptomatic congenital
cytomegalovirus infection: results of a phase II study. National
Institute of Allergy and Infectious Diseases Collaborative Antiviral
Study Group. J Infect Dis. 1997 May;175(5):1080-6.
68. Adler SP, Finney JW, Manganello AM, Best AM. Prevention of
child-to-mother transmission of cytomegalovirus among pregnant women. J
Pediatr 2004;145:485-91.
Η σελίδα έχει εώς τώρα
Επισκέπτες